

向下滾動
海森生物宣布第三代新型PCSK9抑制劑Lerodalcibep臨床試驗申請獲得國家藥品監督管理局CDE批準
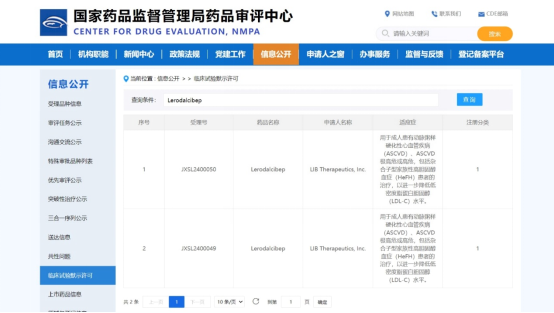
2024年5月17日,海森生物醫藥有限公司(以下簡稱:海森生物)宣布第三代新型PCSK9抑制劑Lerodalcibep(以下稱為HST101)臨床試驗申請(IND)已獲得中國國家藥品監督管理局(NMPA)藥品審評中心(CDE)批準,用于治療高膽固醇血癥患者。公司下一步將加速國內臨床試驗準備工作,并啟動高膽固醇血癥受試者招募。
海森生物首席執行官夏少斐先生表示:“我們很高興HST101臨床試驗申請獲得NMPA的CDE許可,這不僅標志著公司首個IND許可的誕生,也意味著我們第一個在研產品正式進入中國臨床開發階段,更進一步彰顯了海森生物在研管線開發能力正日臻完善,研發進展跑出‘加速度’。”
海森生物首席醫學官肖申博士表示:“根據合作伙伴LIB海外臨床試驗數據顯示,HST101具備令人信服的臨床療效和便于患者使用的特點,我們非常期待其IND在中國患者中的臨床表現。海森生物將全速推動HST101的臨床開發進程,為患有高膽固醇血癥患者提供創新、高效的治療選擇。”
本次獲CDE批準的IND申請包括1期和3期兩個臨床試驗,將由海森生物主導,在中國健康研究參與者(1期)及高膽固醇血癥包括雜合子型家族性高膽固醇血癥(HeFH)患者(3期)中分別進行藥代動力學、藥效學及有效性和安全性評價。繼HST101全球3期海外臨床試驗項目陸續完成并取得積極結果,在中國高膽固醇血癥患者中即將開展的兩個注冊性臨床試驗有望支持Lerodalcibep更快獲批,為醫患提供更具臨床價值的治療新選擇,幫助更多高脂血癥患者盡早實現LDL-C達標。
Lerodalcibep(HST101)是海森生物引入的首個在研創新藥物,與現有7款經典原研藥協同加強了其在慢性病和急重癥領域的產品布局。LIB 計劃將在2024年分別先后向美國食品藥品監督管理局(FDA)和歐洲藥品管理局(EMA)提交生物制品許可申請。雙方將攜手并進,推動創新優勢產品盡快落地,造福更多患者。
關于海森生物醫藥有限公司
海森生物醫藥有限公司(簡稱:海森生物)是一家成立于2020年的創新型生物醫藥企業,業務聚焦于慢性病和急重癥領域。秉承誠信、敏捷、創新和主人翁精神的核心價值觀,海森生物致力于成為中國健康行業引領者,攜手政府相關機構、醫療衛生專業人士及業界合作伙伴,提供優質產品和解決方案,造福更多患者,共創社會健康價值。
關于Lerodalcibep
Lerodalcibep是一種新型、強效、小分子量融合蛋白、第三代PCSK9抑制劑,已被開發為一種更方便、每月一次、注射量小、環境穩定性優越的藥物。經臨床試驗證實,Lerodalcibep可持續降低LDL-C,因此有望為全球數百萬動脈粥樣硬化性心血管疾病(ASCVD)患者以及ASCVD高危患者提供新的治療選擇,這其中包括3000萬患有被稱為家族性高膽固醇血癥(FH)的更嚴重遺傳性高膽固醇血癥患者。
全球III期LIBerate研究共招募2700多名患者,覆蓋包括CVD患者、無CVD但高危和極高危的患者,以及雜合子和純合子家族性高膽固醇血癥(FH)患者等不同人群。關鍵注冊安慰劑對照研究每月注射一次Lerodalcibep,持續52周,超過2400名患者繼續參加72周的開放標簽擴展研究。LIB正準備為Lerodalcibep提交生物制品許可申請(BLA),并計劃在2024年提交上市監管申請。
關于LIB Therapeutics.
LIB Therapeutics是一家私人控股、專注于后期研究的生物制藥公司,致力于為數百萬心血管疾病患者和3000萬家族性高膽固醇血癥(FH)患者提供新型、安全、方便的皮下和口服PCSK9抑制劑。盡管目前這些患者最大限度地耐受他汀類藥物和其他降脂藥物,但仍需進一步大幅降低低密度脂蛋白膽固醇(LDL-C)。
注:本文涉及研究中的藥品尚未在中國獲批,海森生物不推薦任何未被批準的藥品使用。




